Proviamoci

Dato che hai scritto

suppongo che i coefficienti stechiometrici della reazione siano tutti 1, dunque

(essendo la reazione all'equilibrio, tot particelle di

reagiscono con le stesse particelle di
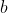
, e se ne formano altrettante di

e altrettante di
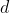
).
Dunque i denominatori son tutti uguali a meno del segno, infatti se da una parte si consumano, dall'altra si formano (poi torna indietro a ristabilire l'equilibrio), basta che sia verificato il bilancio energetico, (sempre coi segni scambiati).
E questo è vero, infatti tutta l'energia che liberano i reagenti trasformandosi in prodotti, sarà quella che (con segno opposto) viene restituita quando la reazione va in verso contrario, dunque è verificata l'uguaglianza.

