Determinate i valori della pressione
SNS n. 4, 2023
SNS n. 4, 2023
Si consideri un contenitore cilindrico rigido e termicamente isolato diviso da una parete mobile parallela alle basi del cilindro in due parti A e B contenenti ciascuna una mole dello stesso gas ideale. La parete impedisce scambi di particelle e di calore tra le due parti. Inizialmente, la posizione della parete è bloccata al centro del contenitore e il sistema è all'equilibrio con le due parti dello stesso volume= V_B(0)) ma temperature diverse
ma temperature diverse >T_B(0)) . Ad un certo istante, la parete mobile viene lasciata libera di scorrere senza attrito mantenendosi parallela alle basi del cilindro e il sistema, dopo un rapido transiente, raggiunge una nuova posizione di equilibrio.
. Ad un certo istante, la parete mobile viene lasciata libera di scorrere senza attrito mantenendosi parallela alle basi del cilindro e il sistema, dopo un rapido transiente, raggiunge una nuova posizione di equilibrio.
Determinate i valori della pressione, P_B(f)) nelle due parti del sistema una volta raggiunta la nuova condizione di equilibrio.
nelle due parti del sistema una volta raggiunta la nuova condizione di equilibrio.
Determinate i valori della pressione
Re: SNS n. 4, 2023
Voglio provare questa soluzione per sottoporla al vs giudizio.
All'istante t=0 abbiamo=V_B(0)=(1/2)V) Pertanto dall'equazione di stato dei gas ideali risulta
Pertanto dall'equazione di stato dei gas ideali risulta }{P_B(0)}=\frac{T_A(0)}{T_B(0)}) ovvero secondo il dato sulle temperature
ovvero secondo il dato sulle temperature >P_B(0)) . Quindi il setto A spinge il setto B fino all'equilibrio raggiunto all'istante finale dove deve essere
. Quindi il setto A spinge il setto B fino all'equilibrio raggiunto all'istante finale dove deve essere =P_B(f)) . La mole nel settore A compie lavoro positivo di espansione e si raffredda visto che non c'è alcuna sorgente esterna di calore. Al contrario la mole in B per lo stesso motivo subisce li lavoro di compressione, opposto al precedente, e si riscalda. Per il secondo principio con Q=0 si ha
. La mole nel settore A compie lavoro positivo di espansione e si raffredda visto che non c'è alcuna sorgente esterna di calore. Al contrario la mole in B per lo stesso motivo subisce li lavoro di compressione, opposto al precedente, e si riscalda. Per il secondo principio con Q=0 si ha -T_A(0)]) e
e  - T_B(0)]) . Essendo i due lavori di segno opposto emerge che la somma delle temperature rimane costante
. Essendo i due lavori di segno opposto emerge che la somma delle temperature rimane costante  +T_B(f)=T_A(0)+T_B(0)) . Se consideriamo le equazioni di stato all'istante finale e che all'equilibrio deve essere
. Se consideriamo le equazioni di stato all'istante finale e che all'equilibrio deve essere =P_B(f)) si ottiene
si ottiene }{V_B(f)}= \frac{T_A(f)}{T_B(f)}) . Applicando il componendo risulta
. Applicando il componendo risulta}{V_A(f)}=\frac{T_A(0)+T_B(0)}{T_A(f)}) In conclusione si ottiene con l'equazione di stato del settore A ( e del settore B) all'istante finale
In conclusione si ottiene con l'equazione di stato del settore A ( e del settore B) all'istante finale =P_A(f)= R\frac{T_A(f)}{V_A(f)}= R[\frac{T_A(0)+T_B(0)}{2V_A(0)}])



All'istante t=0 abbiamo
-
Tarapìa Tapioco
- Messaggi: 146
- Iscritto il: 30 lug 2023, 15:28
Re: SNS n. 4, 2023
Molto bene, bravo. È davvero incredibile come tu sia riuscito (forse inconsapevolmente) a trovare la migliore e più accurata approssimazione al modello in questione. Non so proprio cosa avessero in mente coloro che lo hanno proposto, ma è necessario dire che questo problema sia concettualmente difficile e che non possa essere risolto completamente grazie all'impiego della sola termodinamica classica.
Lungi dal liquidare subito il problema stesso, vorrei sottoporti due (difficili) questioni:
1) A tuo giudizio, perché ho affermato che il tuo procedimento costituisce la migliore approssimazione, ma non l'esatta soluzione (che, comunque, è abbastanza difficile da sviluppare)?
2) Il testo parla di "gas ideale". Secondo te, l'esattezza della tua soluzione è dovuta alla semplice applicazione delle leggi dei gas ideali? Oppure, potrebbe esistere una spiegazione più sottile?
Secondo me hai veramente fatto il massimo. Non importa se non troverai alcuna risposta alle mie domande, ci arriveremo pian piano: questo è un problema di termodinamica avanzata, a mio parere sottovalutato (o formulato male) dagli stessi autori.
Lungi dal liquidare subito il problema stesso, vorrei sottoporti due (difficili) questioni:
1) A tuo giudizio, perché ho affermato che il tuo procedimento costituisce la migliore approssimazione, ma non l'esatta soluzione (che, comunque, è abbastanza difficile da sviluppare)?
2) Il testo parla di "gas ideale". Secondo te, l'esattezza della tua soluzione è dovuta alla semplice applicazione delle leggi dei gas ideali? Oppure, potrebbe esistere una spiegazione più sottile?
Secondo me hai veramente fatto il massimo. Non importa se non troverai alcuna risposta alle mie domande, ci arriveremo pian piano: questo è un problema di termodinamica avanzata, a mio parere sottovalutato (o formulato male) dagli stessi autori.
Re: SNS n. 4, 2023
Inconsapevole sicuramente. Infatti ho pensato che si trattava di una trasformazione spontanea irreversibile che doveva provocare un incremento dell'entropia del sistema e dell'universo che a sua volta in quanto sistema anch'esso isolato contenente il sistema deve subire un incremento entropico. Ho cercato di pensare, senza riuscirci , alla corrispondente trasformazione reversibile lungo cui calcolare la variazione di entropia. Allora ho pensato di andare sul sicuro dal momento che la legge di conservazione dell'energia doveva pur valere con Q=0. Ma ho avvertito un senso di inadeguatezza. Questi problemi (lo ripeto)siano o no consapevoli gli estensori, richiedono degli strumenti anche matematici che in generale non posseggono i liceali. A meno che la cosa non sia intenzionale, come io dubito. Vediamo cosa sanno dire i candidati di problemi che in teoria non possono affrontare. Anche il quinto problema sarà di questo tipo. Grazie comunque delle domande "provocatorie" che mi fai. Ci penserò con il tuo aiuto mi sarà di grande utilità entrare in un territorio sconosciuto perché in piccolo rappresenta la natura della fisica.
-
Tarapìa Tapioco
- Messaggi: 146
- Iscritto il: 30 lug 2023, 15:28
Re: SNS n. 4, 2023
Corretto. Eccellente deduzione. Questo è esattamente il punto a cui volevo arrivare. Secondo te, quale potrebbe essere uno dei motivi (il più semplice, ma anche il più importante) per cui il processo che avviene concordemente alla situazione fisica descritta non può essere reversibile?Higgs ha scritto: ↑17 dic 2023, 11:49 Infatti ho pensato che si trattava di una trasformazione spontanea irreversibile che doveva provocare un incremento dell'entropia del sistema e dell'universo che a sua volta in quanto sistema anch'esso isolato contenente il sistema deve subire un incremento entropico.
Quest'idea contiene alcuni concetti utili (e molto interessanti) per comprendere meglio il modello fisico, tuttavia non può essere applicata nei termini e nelle modalità in cui avresti voluto operare. Non è infatti possibile soddisfare la richiesta del testo (ovvero, il calcolo delle pressioni finali dei due compartimenti del sistema) partendo dalla valutazione della variazione di entropia in corrispondenza di una trasformazione reversibile. Prima di accantonare completamente e interamente la natura irreversibile del processo e concentrarsi esclusivamente sugli stati di equilibrio termodinamico iniziale e finale, è necessario applicare la Prima Legge della Termodinamica al processo irreversibile per determinare lo stato finale di equilibrio termodinamico del sistema: passaggio, quest'ultimo, che non è possibile effettuare senza svolgere (come hai correttamente fatto) adeguate considerazioni su lavoro e variazione di energia interna del sistema, ergo su volume e temperatura finali della trasformazione. Determinare la variazione di entropia sarebbe perciò risultato inutile ai fini prestabiliti, giacché per praticare la prima sarebbero occorsi i medesimi passaggi atti a realizzare i secondi.
Inoltre, non è necessario che la trasformazione reversibile sia corrispondente a quella irreversibile in esame: bisogna certamente ideare un percorso reversibile tra gli stessi due stati di equilibrio termodinamico (punti finali), ma esso non deve obbligatoriamente presentare somiglianze con il percorso del processo irreversibile reale. In questo caso specifico, nonostante il processo irreversibile reale sia adiabatico, il percorso reversibile ideale non deve necessariamente esserlo. Si possono anche separare le varie parti del sistema, sottoponendo ciascuna di esse a un percorso reversibile diverso, purché tutte raggiungano i loro corretti stati finali; esiste, inoltre, un numero infinito di percorsi di processi reversibili che consentono di passare dallo stato iniziale allo stato finale, fornendo tutti esattamente lo stesso valore di variazione di entropia. Appare utile, dunque, elaborare un percorso semplice da gestire e per il quale sia facile valutare l'integrale di
In base a tali indicazioni, prova a calcolare la variazione di entropia in ognuna delle due parti
Per tua sorpresa, invece, la tua idea è risultata vincente: è possibile dimostrare - lo faremo più avanti - che la tua soluzione costituisca la più ragionevole approssimazione. Bisogna, tuttavia, formulare meglio l'idea alla base del tuo ragionamento (che, comunque, è pressoché corretta): il motivo della correttezza dei tuoi risultati risiede nella descrizione della variazione, durante il processo, della forza per unità di superficie sulle facce della partizione in funzione della variazione di volume. L'assunzione (abbastanza accurata) per cui la forza per unità di superficie rimanga, durante il processo, costante alla pressione finale, comporterebbe certamente un aumento dell'entropia della combinazione dei gas, in linea con l'irreversibilità della trasformazione.
Voglio continuare con alcune domande "provocatorie":
1) In una trasformazione rapida irreversibile, il comportamento di un gas ideale non è descritto dalla legge dei gas ideali (nonostante venga ancora chiamato così da tutta la letteratura scientifica). La soluzione da te fornita rappresenta tutto ciò che, riguardo a tale problema, è possibile dire tramite l'utilizzo della sola termodinamica. Migliori e più efficienti spiegazioni devono necessariamente promanare dall'introduzione di un'altra importante (e interessante) branca della Fisica. Quale, secondo te?
2) Ti sei chiesto perché la barriera dovrebbe smettere di muoversi se la pressione (quindi, la forza) su entrambi i lati è la stessa?
Sono più o meno d'accordo, specialmente su questo problema: tralasciando l'ambiguità (dalla richiesta del testo, sembra che gli estensori pretendano dai candidati il calcolo delle due pressioni in una posizione metastabile in cui esse siano differenti: opzione che tuttavia escluderei), nemmeno uno studente universitario sarebbe in grado di risolverlo in maniera esatta (servono software computazionali!). Continuo a pensare che il testo sia stato mal posto (o mal interpretato) da chiunque lo abbia proposto e steso.
Re: SNS n. 4, 2023
Non ho capito perché è mal posto.
Probabilmente l'idea degli autori era di fare un trappolone - molti studenti potrebbero usare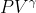 = costante - che però vale solo per le adiabatiche reversibili.
= costante - che però vale solo per le adiabatiche reversibili.
Mi ricordate il perché? Genuinamente questo non me lo ricordo.
Probabilmente l'idea degli autori era di fare un trappolone - molti studenti potrebbero usare
Mi ricordate il perché? Genuinamente questo non me lo ricordo.
"Per un laser, si passa da temperature positive a temperature negative non passando attraverso 0 K, ma passando attraverso l'infinito!" (cit.)
"Perché dovremmo pagare uno scienziato quando facciamo le migliori scarpe del mondo?" (cit.)
"Perché dovremmo pagare uno scienziato quando facciamo le migliori scarpe del mondo?" (cit.)
-
Luca Milanese
- Messaggi: 452
- Iscritto il: 13 giu 2019, 10:05
- Località: Terracina
Re: SNS n. 4, 2023
Per ricavare 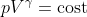 si scrive la Prima Legge della Termodinamica in forma differenziale con
si scrive la Prima Legge della Termodinamica in forma differenziale con 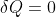 e poi all'espressione di
e poi all'espressione di 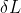 si sostituisce
si sostituisce 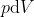 , tuttavia quest'ultima identificazione del lavoro infinitesimo vale solo per trasformazioni quasistatiche.
, tuttavia quest'ultima identificazione del lavoro infinitesimo vale solo per trasformazioni quasistatiche.
Valid Facts and Theoretical Understanding Generate Solutions to Hard Problems
Re: SNS n. 4, 2023
Ok grazie
Metti che tra la parete mobile, di massa piccola ma non nulla così che il peso poggi sui bordi della scatola, e i bordi interni del contenitore ci sia un coefficiente di attrito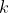 inizialmente infinito, che poi rilassiamo molto lentamente fino a
inizialmente infinito, che poi rilassiamo molto lentamente fino a 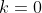 .
.
Non abbiamo sostanzialmente portato il sistema dallo stato iniziale a quello finale, passando solo da trasformazioni quasistatiche?
Metti che tra la parete mobile, di massa piccola ma non nulla così che il peso poggi sui bordi della scatola, e i bordi interni del contenitore ci sia un coefficiente di attrito
Non abbiamo sostanzialmente portato il sistema dallo stato iniziale a quello finale, passando solo da trasformazioni quasistatiche?
"Per un laser, si passa da temperature positive a temperature negative non passando attraverso 0 K, ma passando attraverso l'infinito!" (cit.)
"Perché dovremmo pagare uno scienziato quando facciamo le migliori scarpe del mondo?" (cit.)
"Perché dovremmo pagare uno scienziato quando facciamo le migliori scarpe del mondo?" (cit.)
Re: SNS n. 4, 2023
@Tarapia
La tua prima provocazione è quella di chiedermi di calcolare la variazione entropica separando A da B, cioè la variazione entropica della prima parte e quella della seconda. Siccome deve persistere la costanza della somma delle temperature iniziali e finali+T_B(f) = T_A(0) + T_B(0)) ho pensato di eseguire due trasformazioni reversibili molto semplici che portassero alla fine ciascuna parte nell'isoterma inizialmente dell'altra. Per la parte A: una trasformazione reversibile isocora al volume
ho pensato di eseguire due trasformazioni reversibili molto semplici che portassero alla fine ciascuna parte nell'isoterma inizialmente dell'altra. Per la parte A: una trasformazione reversibile isocora al volume =V_B(0)) in cui la pressione
in cui la pressione ) passa a
passa a ) isoterma iniziale di B;per la parte B:una trasformazione reversibile isobara che portasse B dalla sua pressione iniziale all'isoterma iniziale di A. Più in dettaglio:
isoterma iniziale di B;per la parte B:una trasformazione reversibile isobara che portasse B dalla sua pressione iniziale all'isoterma iniziale di A. Più in dettaglio:
A esegue una trasformazione a lavoro nullo per cui
}{T_A(0)} <0)
B esegue una trasformazione per cui riceve calore da una sorgente esterna in parte per compiere lavoro di espansione positivo ed in parte per aumentare la propria energia interna Quindi la sua variazione di entropia è positiva e maggiore in valore assoluto di quella negativa di A.
}^{T_A(0)}\frac{c_p dT} {T} = c_p log \frac {T_A(0)}{T_B(0)})
Mi chiedi cosa si può dire. A diminuisce entropia perché si raffredda. Ma l'aumento di entropia di B è maggiore della diminuzione di quella di A essendo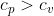 . Quindi il bilancio complessivo del sistema fa registrare un incremento di entropia come deve essere per l'irreversibilità della trasformazione. A domani per il resto.
. Quindi il bilancio complessivo del sistema fa registrare un incremento di entropia come deve essere per l'irreversibilità della trasformazione. A domani per il resto.
La tua prima provocazione è quella di chiedermi di calcolare la variazione entropica separando A da B, cioè la variazione entropica della prima parte e quella della seconda. Siccome deve persistere la costanza della somma delle temperature iniziali e finali
A esegue una trasformazione a lavoro nullo per cui
B esegue una trasformazione per cui riceve calore da una sorgente esterna in parte per compiere lavoro di espansione positivo ed in parte per aumentare la propria energia interna Quindi la sua variazione di entropia è positiva e maggiore in valore assoluto di quella negativa di A.
Mi chiedi cosa si può dire. A diminuisce entropia perché si raffredda. Ma l'aumento di entropia di B è maggiore della diminuzione di quella di A essendo
-
Tarapìa Tapioco
- Messaggi: 146
- Iscritto il: 30 lug 2023, 15:28
Re: SNS n. 4, 2023
Si tratta di una mera opinione personale. Questo problema non è inedito, dal momento che è contenuto nella sezione "Termodinamica" di molti volumi di Fisica (tra tutti, mi viene in mente Physics - 9th edition di Cutnell & Johnson, Chapter 15, Problem 33): nella totalità dei casi, la soluzione fornita corrisponde a quella ottenuta considerando adiabatica reversibile la trasformazione in atto (cioè, impiegando la legge
Non si può escludere tale possibilità, pertanto potresti avere ragione. L'argomento del "trappolone", tuttavia, funziona fino ad un certo punto. Nonostante possano essere addotte parecchie prove a sostegno dell'impossibilità di considerare reversibile una trasformazione come quella presentata dal problema in esame, uno studente che abbia affrontato Termodinamica a livelli più o meno alti potrebbe benissimo obiettare che, se la barriera si muovesse a una velocità significativamente inferiore a quella del suono - pari o inferiore ad una bassa percentuale -, la pressione nelle camere avrebbe il tempo di equilibrarsi e il processo sarebbe sufficientemente vicino alla reversibilità da poter essere descritto dall'equazione
A questo punto, si profilano due opzioni estremamente contraddittorie e inconciliabili:
1) L'unica possibilità che giustifichi la ragionevolezza e la coerenza del testo del problema risiede nella necessità di non definire la trasformazione termodinamica, escludendo a priori qualsiasi ipotesi di considerazione su reversibilità o irreversibilità di quest'ultima: poiché viene detto soltanto che avviene un "rapido transiente", non è possibile sapere quale tipo di trasformazione abbia luogo durante il processo. Estrapolando l'informazione sul carattere ideale del gas, è sufficiente applicare l'equazione di stato dei gas perfetti e imporre l'uguaglianza delle pressioni nei due compartimenti all'equilibrio finale: il problema, dunque, sarebbe un semplice esercizio prevedente l'applicazione di una legge congiuntamente ad alcune manipolazioni algebriche, senza che possano essere avanzate - eccetto il carattere adiabatico della trasformazione - osservazioni sulla particolare situazione fisica. Rinunciando a conoscere il tipo di processo, si conferisce ad ognuna delle due possibilità (reversibilità e irreversibilità) la medesima percentuale di realizzazione, cosicché la trasformazione possa essere indifferentemente considerata reversibile o irreversibile senza che tale indecisione sortisca effetto sullo svolgimento del problema.
2) D'altro canto, tuttavia, è possibile individuare un (apprezzabile) numero di prove a sostegno della tesi dell'irreversibilità del processo, totalmente corrispondente a quello di argomenti atti a respingere l'idea di reversibilità dello stesso. Questo giudizio è estremamente in disaccordo con il punto precedente. Pertanto, se si accetta la contraddizione, bisogna abbandonare ogni valutazione della situazione fisica e accontentarsi semplicemente di una nota soluzione; se non la si accoglie, è necessario riconoscere il carattere altamente irreversibile del processo e, con esso, la necessità di considerare la (pur corretta) applicazione della legge dei gas perfetti come un'approssimazione (per quanto abbastanza accurata) e l'impossibilità di risolvere il problema in maniera esatta. In una trasformazione irreversibile, il comportamento di un gas ideale non è descritto dalla legge dei gas ideali (nonostante venga ancora così chiamato), la quale può essere applicata (non necessariamente, però) soltanto all'equilibrio termodinamico, in corrispondenza di stati in cui il gas non si espande o comprime improvvisamente. Anche se gli stati iniziale e finale costituiscono stati di equilibrio termodinamico, ciò non è sufficiente: affinché la legge dei gas ideali sia perfettamente applicabile, il processo in questione deve essere all'equilibrio termodinamico in tutti gli stati intermedi, ovvero consistere in una sequenza continua di stati di equilibrio termodinamico sull'intero percorso del processo, dimodoché non siano ammessi cambiamenti spontanei che coinvolgano stati di non-equilibrio. Ecco uno dei motivi per cui, in una trasformazione irreversibile, l'impiego di
Tale discorso non inficia la correttezza della soluzione di @Higgs (che, tra l'altro, avevo ricavato anche io in forma totalmente analoga), ma mira a constatare la rischiosità insita nella proposta di questo genere di problemi: non reputo infondato affermare che, probabilmente, gli autori del problema ne abbiano sottovalutato la portata, interpretandolo (o ponendolo) male e acconsentendo alla circolazione di un esercizio enormemente più complesso di quanto, in verità, avrebbero voluto che fosse.
Il condensato di constatazioni di cui sopra costituisce soltanto una presentazione delle insidie celate dal problema: qualora tu accettassi e accogliessi la "sfida", potremmo iniziare una discussione più dettagliata sull'interessante situazione fisica.
Sì, secondo me hai ragione. Le trasformazioni in atto possono essere quasistatiche, purché avvengano abbastanza lentamente da mantenere infinitesimale la differenza di pressione tra le parti, e a patto che non vi siano gradienti di temperatura all'interno di ciascun gas.Pigkappa ha scritto: ↑18 dic 2023, 13:22 Metti che tra la parete mobile, di massa piccola ma non nulla così che il peso poggi sui bordi della scatola, e i bordi interni del contenitore ci sia un coefficiente di attritoinizialmente infinito, che poi rilassiamo molto lentamente fino a
.
Non abbiamo sostanzialmente portato il sistema dallo stato iniziale a quello finale, passando solo da trasformazioni quasistatiche?
