2) La trasformazione è adiabatica perché il gas non scambia alcun calore con l'esterno per ipotesi. La variazione di entropia è nulla perchè la trasformazione è reversibile (basta infatti spostare indietro il pistone fino a farlo tornare nella posizione iniziale) e dunque possiamo usare
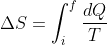
, con
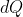
sempre nullo. Per ottenere tutti gli altri valori tipicamente rilevanti, ricorriamo all'equazione di stato
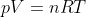
, all'equazione dell'adiabatica

, con

perchè l'elio è un gas monoatomico, e alla prima legge della termodinamica

, con

. Definendo
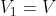
e
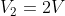
, si ottengono:
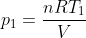
,
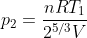
,
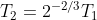
,
=\frac{3nRT_1(1-2^{2/3})}{2^{5/3}})
,
}{2^{5/3}})
.
1) Dato che non sono riuscito a fare molto altro, posto almeno quanto ho ottenuto. Quando la valvola viene aperta, si ha una libera espansione, in cui
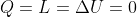
. Tuttavia, la variazione di entropia non è nulla, perchè questa è chiaramente una trasformazione irreversibile. Per calcolarla quantitativamente ricorro (Halliday docet) alla formula di Boltzmann
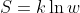
, dove, se consideriamo le due metà di un contenitore, in cui si trovano
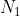
ed
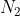
molecole,
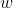
è definita come
!}{N_1!N_2!})
. Nel nostro caso allora avremo

,
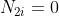
,

, perchè raggiunto l'equilibrio abbiamo la stessa quantità di moli e quindi di molecole in ciascuna metà del contenitore. Da qui ottengo
!^2}- k \ln \frac{N!}{N!}=k(\ln N! - 2\ln (N/2)!)-0 \simeq k[(N \ln N - N) -2(N/2 \ln N/2 - N/2)]=kN \ln 2 = knN_a \ln 2=nR \ln 2)
.
È la prima volta che mi capita di usare questa formula per cui è probabile che abbia sbagliato parecchie cose. Continuerò a pensare al resto del punto 1) ma se qualcun altro vuole farsi avanti al posto mio ovviamente può.
