Pagina 1 di 2
Espansione adiabatica
Inviato: 14 mar 2009, 16:27
da pascal
Un gas ideale monoatomico, racchiuso in un cilindro munito di pistone privo di attrito e a tenuta perfetta , è in equilibrio ad una data pressione e alla temperatura di 26,85 °C. Se la pressione esterna viene improvvisamente dimezzata ed il contenitore risulta adiabatico, quanto sarà la temperatura finale del gas?
Re: Espansione adiabatica
Inviato: 14 mar 2009, 18:24
da Albertopisa
pascal ha scritto:Un gas ideale monoatomico, racchiuso in un cilindro munito di pistone privo di attrito e a tenuta perfetta , è in equilibrio ad una data pressione e alla temperatura di 26,85 °C. Se la pressione esterna viene improvvisamente dimezzata ed il contenitore risulta adiabatico, quanto sarà la temperatura finale del gas?
Ci provo:
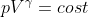
Sostituendo l'espressione
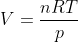
Si ottiene la relazione
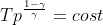
Da questa si puo' poi ottenere
}^{\frac{1-\gamma}{\gamma}})
^{\frac{1-\gamma}{\gamma}})
Re: Espansione adiabatica
Inviato: 14 mar 2009, 19:30
da pascal
Hai applicato l'equazione dell'adiabatica reversibile.
Per trasformazioni adiabatiche irreversibili conviene
partire dal lavoro svolto effettivamente dal sistema.
Re: Espansione adiabatica
Inviato: 14 mar 2009, 20:51
da Albertopisa
Ok, me ne sono accorto dopo...
Sto provando con la trasformazione irreversibile...
Re: Espansione adiabatica
Inviato: 15 mar 2009, 14:56
da Ippo
Assumendo che la variazione "improvvisa" della pressione sia istantanea, abbiamo che il lavoro svolto sul sistema è
\cdot A \Delta y)
(segno meno perché la forza esercitata dall'ambiente esterno si oppone all'espansione).
Ma
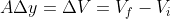
, quindi abbiamo
 nR \Delta T=Q-W=-\(P/2\)\cdot (V_f-V_i))
.
Ora però, applicando la legge dei gas perfetti allo stato inziale e finale, abbiamo
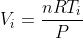
e
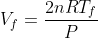
, che sostituite nell'espressione della variazione di energia interna danno
nR(T_f-T_i)=-(1/2)nR(2T_f-T_i))
.
Infine, semplificando,
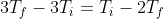
, da cui
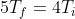
,
T_i)
,
Se ne deduce che
V_i)
.
EDIT: ho corretto la cazzata
Re: Espansione adiabatica
Inviato: 15 mar 2009, 15:45
da CoNVeRGe.
Ippo ha scritto:
 nR \Delta T=Q-W=\(P/2\)\cdot (V_f-V_i))
ops, distrazione: il lavoro W del gas sull'ambiente è positivo, quindi
 nR \Delta T=Q-W=- \(P/2\)\cdot (V_f-V_i))
da cui
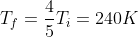
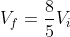
nel processo reversibile sarebbe
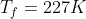
ora chiedo: quanto è giusto assumere come forza durante tutta la trasformazione F=pA/2 ? (ovvero il procedimebnto di Ippo)
Re: Espansione adiabatica
Inviato: 15 mar 2009, 16:01
da Albertopisa
Provo a seguire il suggerimento: dato che la pressione esterna puo' essere considerata costante, si ha:
}{2} = \frac{p_i n R}{2}\left(\frac{T_f}{p_f} - \frac{T_i}{p_i}\right))
Ma, dato che il recipiente e' adiabatico, il lavoro sara' uguale a
per cui:
 = \frac{3 n R}{2}\left(T_i - T_f \right))
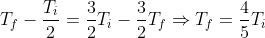
Re: Espansione adiabatica
Inviato: 15 mar 2009, 16:26
da pascal
La temperatura deve diminuire perchè il sistema compie
lavoro a discapito dell'energia interna.
Esatto 240 K per l'irreversibile.
Re: Espansione adiabatica
Inviato: 15 mar 2009, 21:35
da Ippo
Ah già, ho calcolato W come lavoro fatto
sul sistema usando poi la convenzione sui segni per il lavoro W fatto
dal sistema, è chiaro che così viene un'assurdità. Scusate

Re: Espansione adiabatica
Inviato: 15 mar 2009, 22:05
da Ippo
CoNVeRGe. ha scritto:ora chiedo: quanto è giusto assumere come forza durante tutta la trasformazione F=pA/2 ? (ovvero il procedimebnto di Ippo)
Capisco quello che vuoi dire, il processo non è "quasi-statico" quindi il pistone non è in equilibrio in ogni istante del moto, anzi accelera e poi frena perché su di esso agiscono due forze di cui una (quella esercitata dall'interno) variabile. Il fatto è che l'andamento della forza esercitata dall'interno in funzione del tempo t o dell'altezza del pistone y non ci interessa, perché alla fine del processo (a equilibrio raggiunto) il pistone è in quiete così come all'inizio, per cui il lavoro netto svolto su di esso è zero:
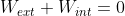
. Quindi (con le dovute cautele sui segni

) considerare il lavoro svolto dall'esterno è corretto tanto quanto considerare quello svolto dall'interno, ma comporta la notevole semplificazione di avere una forza costante (e quella esercitata dall'esterno è effettivamente costante nelle ipotesi del problema).