Il risultato vi sembra compatibile con il secondo principio della termodinamica? Giustificate la vostra risposta
SNS 1989-1990 (3)
SNS 1989-1990 (3)
Un cilindro chiuso da un pistone mobile e contenente una mole di gas biatomico è posto in contatto termico, attraverso la parete di fondo, con una sorgente a temperatura 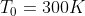 . Il volume iniziale del cilindro è
. Il volume iniziale del cilindro è  litri. Calcolare
litri. Calcolare 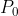 . In maniera reversibile, il gas viene fatto espandere fino ad un volume finale doppio di quello iniziale, mantenedo sempre il cilindro in equilibrio termico con la sorgente. calcolare il calore scambiato dal gas e il lavoro compiuto ed esprimere i valori in joules.
. In maniera reversibile, il gas viene fatto espandere fino ad un volume finale doppio di quello iniziale, mantenedo sempre il cilindro in equilibrio termico con la sorgente. calcolare il calore scambiato dal gas e il lavoro compiuto ed esprimere i valori in joules.
Il risultato vi sembra compatibile con il secondo principio della termodinamica? Giustificate la vostra risposta
Il risultato vi sembra compatibile con il secondo principio della termodinamica? Giustificate la vostra risposta
Re: SNS 1989-1990 (3)
Dall'equazione di stato dei gas perfetti si ha

Dato che la temperatura rimane costante si ha
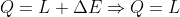

Da cui

Dato che la temperatura rimane costante si ha
Da cui
Re: SNS 1989-1990 (3)
Il dubbio sull'incompatibilità del fenomeno con il secondo principio potrebbe saltar fuori se si assume il gas come sistema.
Abbiamo infatti che assorbe calore da una sorgente e lo traduce interamente in lavoro, assurdo per il principio nella formulazione Kelvin-Planck.
Ma l'unico risultato della trasformazione termodinamica non è il compimento del lavoro ma anche la modifica della situazione iniziale (posizione del gas e del pistone).
Inoltre l'entropia dell'universo è costante perchè vi è uno scambio di calore a temperatura costante, dunque l'entropia acquistata dal gas è quella persa dalla sorgente.
Penso basti questo.
Abbiamo infatti che assorbe calore da una sorgente e lo traduce interamente in lavoro, assurdo per il principio nella formulazione Kelvin-Planck.
Ma l'unico risultato della trasformazione termodinamica non è il compimento del lavoro ma anche la modifica della situazione iniziale (posizione del gas e del pistone).
Inoltre l'entropia dell'universo è costante perchè vi è uno scambio di calore a temperatura costante, dunque l'entropia acquistata dal gas è quella persa dalla sorgente.
Penso basti questo.
