Penso sia un po' esagerato dire che l'atmosfera sia spessa 200km.
Per convenzione l'atmosfera termina quando la sua densità ad una data altitudine è uguale a quella del mezzo interplanetario. Però, anche se il limite così definito viene posto a 2000km di altezza sul livello del mare, a noi interessa capire quando sarebbe spessa l'atmosfera se immaginassimo di comprimerla così che abbia densità uniforme..
Per fare questo dobbiamo stimare la densità dell'atmosfera ad una data altitudine e, se sufficientemente bassa, possiamo porre il limite che ci interessa.
Assumiamo che la temperatura nella troposfera (
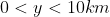
) diminuisca a ritmo costante
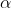
.
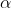
si può ricavare e, in prima approssimazione, possiamo stimarlo a
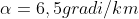
A partire dall'equazione di stato dei gas perfetti, indicando con
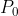
,
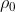
e
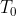
rispettivamente la pressione, la densità (moli per volume) e la temperatura al livello del mare e con
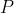
,
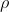
e
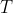
rispettivamente la pressione, la densità (moli per volume) e la temperatura ad una quota generica
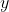
, abbiamo che:
})
La differenza infinitesimale di pressione
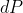
è data da:

Dove

è la massa di uno strato di aria di spessore
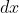
e area
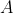
.
Eseguendo i calcoli si ottiene:
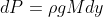
Dove M è la massa molare dell'aria che si può ottenere come media pesata tra azoto e ossigeno molecolari.
Unendo le due equazioni e integrando si ottiene, infine:
}^{\frac {gM}{\alpha R} -1} \rho_0)
Sostituendo per i valori numerici:
}^{4,08} \rho_0)
Questa equazione è valida solo nella troposfera. In effetti, la tropopausa, che separa la fine della troposfera con l'inizio della stratosfera, è individuata dell'inversione dell'andamento della temperatura: da qui in poi, la temperatura inizia ad aumentare fino al limite della stratosfera a causa della scissione di O3 in O2 e O dovuta a raggi UV altamente energetici.. ecc.
Notiamo che nella stratosfera, quindi, la diminuzione della densità all'aumentare dell'altitudine è molto più brusca rispetto a quella nella troposfera, grazie all'ell'effetto combinato dell'aumentare della temperatura e alla diminuzione della pressione (prima la temperatura scendeva e i due effetti quasi si bilanciavano.
In modo simile ricaviamo l'andamento della densità nella stratosfera:
}{T_0 -\alpha y_1} \right)}^{ -\left( \frac {gM}{\beta R} +1 \right)} \cdot {\left( 1- \frac{\alpha y_1}{T_0} \right)}^{\left( \frac {gM}{\alpha R} -1 \right)} \rho_0)
Dove
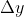
è la distanza dal limite superiore della troposfera (10km), e
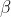
è la rapidità con cui aumenta la temperatura nella stratosfera.
Sostituendo per i valori numerici:
}^{-26,15} \cdot 0,3415 \rho_0)
Per
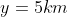
,
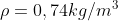
Per
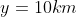
,
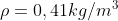
Per

,
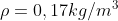
Per
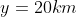
,
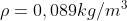
Per

,

Per

,

Vediamo quindi che, approssimativamente, lo spessore che avrebbe l'atmosfera se venisse compressa per portarla a densità costante sarebbe di circa 10-14km
EDIT:
Per calcolare in maniera più precisa lo spessore dell'atmosfera, possiamo calcolare il numero di moli comprese nella troposfera, sommarle a quelle comprese nella stratosfera per poi calcolare il volume assumendo densià costante
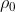
.
Moli troposfera:
}^{\frac {gM}{\alpha R} -1} \rho_0 \cdot 4 \pi {\left ( R_{terra}+ y \right)}^2 dy })
Approssimando brutalmente si ottiene:
}^{4} })
Da cui ricaviamo che le moli di aria presenti nella troposfera sono:

Moli stratosfera:
Procediamo in modo simile per ricondurci all'equazione:
}^{-26}dy })
Da cui otteniamo:
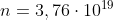
Vediamo che nella troposfera ci sono 4 volte più moli che nella stratosfera e, complessivamente, la troposfera conterrà tra il 70% e l' 80% dell'aria presente in tutta l'atmosfera.
Sommando le moli e prendendo
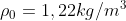
, otteniamo uno spessore dell'atmosfera di:

EDIT 2:
Ovviamente bastava dire:
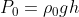
Da cui otteniamo esattamente il risultato precedente. Cosa ci porta a concludere? Le moli di aria comprese negli strati più alti dell'atmosfera sono praticamente trascurabili. Dai calcoli ricaviamo che la troposfera contiene poco meno dell' 80% delle moli di aria in tutta l'atmosfera, mentre la stratosfera poco meno del 20%.
"No, no, you're not thinking; you're just being logical. "