Il processo termodinamico che permette la crescita della temperatura dell'acqua nella
sfera da 0°C a 100°C avviene per conduzione. L'espressione del trasferimento di energia
in funzione della differenza di temperatura è:
]\;dt=kA[T_{ext}-T(t)]\;dt}.)
(Per favore lasciamo perdere che dQ non è un differenziale esatto... Ancora devo capire
che significa, quindi prendete questa imprecisione come una "licenza poetica")
Applicando questa espressione al processo di fusione si può pervenire a:

,
dove

, ovvero è la differenza tra la sorgente calda e quella fredda.
Dunque:

.
Ricordando che il calore in generale è calcolabile come:
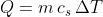
, possiamo ricondurci alla forma differenziale che esprime
in modo più universale questo concetto:
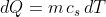
.
Possiamo da ciò scrivere:
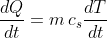
.
All'inizio è stata scritta la forma differenziale del calore nella conduzione, che possiamo recuperare così:
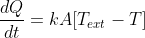
.
Eguagliando le ultime due espressioni si ha:
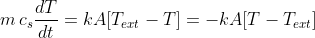
.
Possiamo così manipolare l'uguaglianza per trarne informazioni preziose:
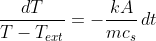

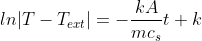
.
Riscrivendo quanto sopra in forma esponenziale si ottiene:

.
Bisogna osservare adesso che, sciogliendo il valore assoluto, è indifferente considerare
il segno + o -, perchè anche in caso di errore, si può modificare il segno del
coefficiente h in modo opportuno.
Quindi abbiamo:
=T_{ext}+he^{\displaystyle{-\frac{kA}{mc_s}t }})
.
Al tempo t=0 l'acqua inizialmente ghiacciata è ancora a 0°C ossia a 273 K. Però il valore
h non cambia se si sceglie la scala Celsius o quella Kelvin.
La dimostrazione è equivalente (qui riporto quella per le temperature in °C):
=T_{ext}+h\,\,\Rightarrow \,\,h=-T_{ext}=-200)
.
Si nota che h equivale alla differenza di temperatura iniziale negativa

.
Quindi la formula diventa:
=T_{ext}-\Delta T_0e^{\displaystyle{-\frac{kA}{mc_s}t}}=T_{ext}-\Delta T_0e^{\displaystyle{-\frac{t}{\tau} }})
.
Il coefficiente che compare davanti alla variabile temporale può essere definito come
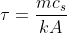
, che è stato parzialmente ricavato
all'inizio come
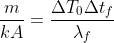
.
Quindi risulta

,
in cui il calore specifico dell'acqua è
)
. Si osserva
giustamente che

è espressa in 1/s.
Ora possiamo finalmente rispondere alla domanda della traccia: in quanto tempo l'acqua
raggiunge i 100 °C?
Basta porre:
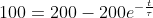
,
quindi:
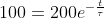
, da cui:

.
Il valore numerico è però un po' anomalo...
@Pigkappa: il problema non è solo fare i calcoli, ma anche tradurre tutto in LaTeX... Ci ho messo buona mezz'ora.
In nature we do not find past, present and future as we recognise them, but an evolutionary process of change - energy never trapped for too long - life always becoming.
(Taken and modified from Lighthousekeeping by J. Winterson)