Pagina 1 di 2
Lavoro termodinamico
Inviato: 30 ago 2010, 10:09
da Gia91
Per convenzione si stabilisce che il lavoro fatto su un sistema termodinamico si considera negativo, positivo se viene fatto dal sistema.... Ma l'Halliday dice il contrario. In dedinitiva è solo una questione di segno che va a modificare l'espressione della prima legge della termodinamica, o aggiunge un meno davanti all'integrale per calcolare il lavoro stesso. Ma per correttezza, che convenzione usare? Si fa un po' di confusione così...
Re: Lavoro termodinamico
Inviato: 30 ago 2010, 12:03
da Ippo
La forma più "convenzionale" della prima legge, che io sappia, è
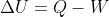
dove è chiaro che il calore Q è considerato positivo se è assorbito dal sistema (aumenta U) e negativo se ceduto dal sistema; viceversa W è positivo se fatto dal sistema sull'esterno (fa diminuire U) e negativo altrimenti.
L'Halliday quindi usa
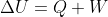
? Non lo ricordavo!

Re: Lavoro termodinamico
Inviato: 30 ago 2010, 14:00
da MrTeo
È il vecchio problema delle diverse convenzioni tra testi americani ed europei... qualche volta capita anche con le lenti

Re: Lavoro termodinamico
Inviato: 30 ago 2010, 14:43
da Pigkappa
Ippo ha scritto:La forma più "convenzionale" della prima legge, che io sappia, è
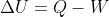
dove è chiaro che il calore Q è considerato positivo se è assorbito dal sistema (aumenta U) e negativo se ceduto dal sistema; viceversa W è positivo se fatto dal sistema sull'esterno (fa diminuire U) e negativo altrimenti.
L'Halliday quindi usa
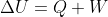
? Non lo ricordavo!

Veramente anche a me sembrava che l'Halliday usasse
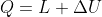
...
Re: Lavoro termodinamico
Inviato: 30 ago 2010, 15:10
da CoNVeRGe.
Ciò che varia l'energia di un sistema è il lavoro delle forze sui suoi componenti e non su quelli dell'ambiente.
Se prendete come sistema un oggetto che si muove su un tavolo scabro e fisso, avete che il lavoro per attrito dinamico fatto sul sistema è non nullo, mentre quello "fatto dal sistema" è nullo.
L'equazione corretta è quindi
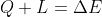
L'equazione con segno meno si ha come caso particolare prendendo, per esempio, un fluido come sistema e considerando forze "di pressione" di un pistone: in questo caso il lavoro sul sistema è lo stesso (cambiato di segno) del lavoro fatto sul pistone.
Re: Lavoro termodinamico
Inviato: 30 ago 2010, 16:15
da Gia91
CoNVeRGe. ha scritto:Ciò che varia l'energia di un sistema è il lavoro delle forze sui suoi componenti e non su quelli dell'ambiente.
Se prendete come sistema un oggetto che si muove su un tavolo scabro e fisso, avete che il lavoro per attrito dinamico fatto sul sistema è non nullo, mentre quello "fatto dal sistema" è nullo.
L'equazione corretta è quindi
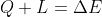
L'equazione con segno meno si ha come caso particolare prendendo, per esempio, un fluido come sistema e considerando forze "di pressione" di un pistone: in questo caso il lavoro sul sistema è lo stesso (cambiato di segno) del lavoro fatto sul pistone.
Quindi nei problemi di termodinamica posso usare
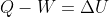
? O Comunque, in generale, quando risolvo un problema in cui devo usare questa uguaglianza, specifico che convenzione sto usando per i segni?
Ippo ha scritto:L'Halliday quindi usa
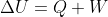
? Non lo ricordavo!
Sisi...usa questa convenzione...
Re: Lavoro termodinamico
Inviato: 30 ago 2010, 20:10
da CoNVeRGe.
In generale non si tratta di una convenzione, perchè solo una delle due forme è corretta.
Nel caso più comune per i problemi (compressioni dovute a pistoni o che altro) poichè il lavoro fatto sul sistema è l'opposto del lavoro "fatto dal sistema" (per il terzo principio della dinamica e perchè gli spostamenti marcoscopici sono gli stessi) allora puoi scegliere la convenzione che ti pare senza troppi problemi: non ne esiste una in particolare, come per esempio la convenzione sulle cariche (positive e negative).
Re: Lavoro termodinamico
Inviato: 31 ago 2010, 12:32
da Ippo
Gia91 ha scritto:Quindi nei problemi di termodinamica posso usare
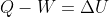
? O Comunque, in generale, quando risolvo un problema in cui devo usare questa uguaglianza, specifico che convenzione sto usando per i segni?
Nei problemi puoi fare quello che ti pare, basta che specifichi (se non è del tutto ovvio) con che segni consideri le varie quantità.
CoNVeRGe. ha scritto:L'equazione con segno meno si ha come caso particolare prendendo, per esempio, un fluido come sistema e considerando forze "di pressione" di un pistone: in questo caso il lavoro sul sistema è lo stesso (cambiato di segno) del lavoro fatto sul pistone.
vabbè non è un caso particolare così infrequente in termodinamica

Re: Lavoro termodinamico
Inviato: 1 set 2010, 12:02
da Ippo
Ho fatto un rapido controllo su vari testi di termodinamica e fisica statistica. Sull'Halliday-Resnick-Krane in effetti è usata la forma
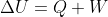
; invece il Mazzoldi, il Rosati, il Fermi (i principali libri di termodinamica usati al primo anno di fisica), il Huang (testo classico di meccanica statistica) e il Guadagnini (testo di meccanica statistica usato al secondo anno a Pisa) usano tutti la forma
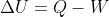
. Storicamente è più usata perchè la formula per il differenziale di U in un sistema termodinamico è
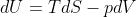
e viene spontaneo chiamare
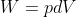
più che il suo opposto.
Re: Lavoro termodinamico
Inviato: 1 set 2010, 12:41
da CoNVeRGe.
Ippo ha scritto:vabbè non è un caso particolare così infrequente in termodinamica

Già, nei problemi si incontrano praticamente sempre fluidi e compressioni che ti permettono di eguagliare il lavoro sul sistema con quello "fatto dal sistema" (oppure lo si assume) e si usano spesso le freccette da un sistema all'altro ad indicare il calore e il lavoro che fluiscono

.
Ma è noto che la concezione di calore come qualcosa che passa da un sistema all'altro è superata, e credo che lo si possa vedere solo facendo la distinzione tra i due lavori.
Infatti se prendiamo due sistemi chiusi e interagenti tra loro ma isolati dal resto (quindi uno si può chiamare ambiente) si ha che
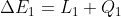
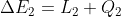
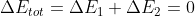
E quindi:
)
Siccome non si ha necessariamente
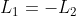
, non si ha nemmeno
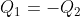
.
Infine: poichè il primo principio è fondamentale, nel senso che lo si vuole applicare a qualsiasi tipo di sistema, secondo me è rilevante fare questa distinzione che mi pare non venga fatta spesso. Poi se a qualcuno non frega nulla di queste robe teoriche è ok, la mia risposta al topic è questa.
